CLSTの技術を見る
人工アミノ酸のタンパク質への部位特異的導入技術
概要
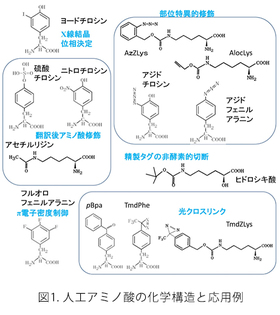
本技術は、タンパク質に人工のアミノ酸を、部位特異的に導入することを可能にします。応用としましては、(1)天然の修飾アミノ酸(アセチルリジン、硫酸チロシン、ニトロチロシンなど)を望みの部位に持つリコンビナント・タンパク質を作製すること、(2)アジド基などのタンパク質中には存在しない官能基を導入することで、リジン残基やシステイン残基に依存しない部位特異的な修飾を可能にすること、(3)光に反応して近傍の分子と共有結合を形成する能力を持った人工アミノ酸(光クロスリンカー)をタンパク質に部位特異的に導入し、タンパク質間相互作用の解析に役立てること、(4)人工のアミノ酸をタンパク質の複数部位に導入することでタンパク質の構造安定性を高めること、などがすでに実用化されています。これらの技術は、MTA(Material Transfer Agreement)や共同研究を通じて外部の研究者や企業に提供を行っています。
背景
1970年代に登場した組換えDNA技術は、均一なタンパク質の大量発現を可能にしました。タンパク質を研究試料としてだけでなく、工業用酵素やバイオ医薬品として大量に生産することに大きな貢献をしています。組換えDNA技術は、大腸菌などのホスト生物・ホスト細胞に遺伝子を導入してタンパク質を発現させることが基本ですから、ホスト生物の遺伝暗号に依存したタンパク質合成を行っていると言えます。後で説明しますように、ほとんどの生物で遺伝暗号が共通であることから、組換えDNA技術の基本要素としての遺伝暗号システムには意識が及ぶことはほとんどないようです。しかし、天然の遺伝暗号を利用していることは、すなわち、組換えタンパク質を構成するアミノ酸の種類を通常の20種類に限定することであります。そもそも組換えDNA技術が人為的に開発された技術ですから、さらなる有用性、応用を目指して、ホスト生物の遺伝暗号の改変に進むことは必然でしょう。特に、天然のタンパク質の多くが部位特異的な修飾を受けて機能していることを考えますと、20種類というアミノ酸のレパートリーは、本来、タンパク質の機能を十全に発揮する上で十分ではないと言えるかもしれません。しかし、「普遍遺伝暗号」という用語が存在するように、少数の例外はあっても、ほとんどの生物で遺伝暗号は共通であり、このことは生命進化の初期に遺伝暗号が成立したことを示唆しています。その後は、アミノ酸のレパートリーは30億年以上ほとんど変化していないことになります。私たちは、生物にとってそれほど基本的、本質的なしくみである遺伝暗号を本当に変えられるのかどうかに興味を持ち挑戦してきました。遺伝暗号改変のヒントは遺伝暗号表の中にありました。遺伝暗号表では、64のコドンが20種類のアミノ酸と翻訳終止に対応しているので、いくつかのコドンを人工のアミノ酸に割り当てるということが可能に思えます。このことを基本的な開発コンセプトとしますと、後は技術的な問題になりました。非天然型アミノ酸導入技術を利用する上で、技術の詳細を理解することはあまり重要ではないので、遺伝暗号が改変されたどのようなホスト細胞・ホスト生物が利用できるかを簡単に説明したいと思います。応用例については、詳しくは参考文献をご覧ください。
非天然型アミノ酸のタンパク質への導入に利用できるホスト細胞・ホスト生物
- 動物細胞
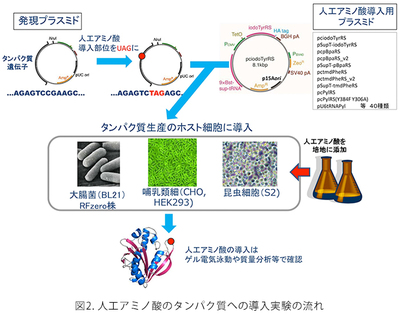
哺乳類細胞(CHO細胞、HEK細胞)、昆虫S2細胞を使って人工のアミノ酸をタンパク質に導入することができます。人工アミノ酸の導入位置は、遺伝子上でUAGコドンによって指定します。このとき、UAGコドンは人工アミノ酸を指定するだけでなく、本来の翻訳終止の働きもしますので、UAGコドンまでタンパク質合成が進んだところで、人工アミノ酸が伸長ポリペプチド鎖に取り込まれるか、この位置でタンパク質合成が終結するかの2つの場合が生じます。無事人工アミノ酸が取り込まれると、タンパク質合成は次の終止コドン(UAAかUGA)まで進みますで、期待される長さのタンパク質産物が得られます。人工アミノ酸が取り込まれなかったポリペプチド鎖は不完全長の産物を生じますので簡単に分離できます。完全長産物の生産効率は、UAGコドンで中断されていない野生型産物の5~20%程度です。実用上、1つのタンパク質に人工アミノ酸は一か所だけ導入できます。また、人工アミノ酸の導入位置によってはほとんど合成されないことがありますが、どのような部位でこのような問題が起きてしまうのかについては一般的な法則は知られていませんので、導入部位については試行錯誤が必要な場合があります。このような人工アミノ酸の導入を実現するためには、(1)人工アミノ酸を培地中に添加する、(2)人工アミノ酸の導入を可能にするしくみを載せたプラスミドで細胞を形質転換する、だけで十分です。このようなプラスミドはMTAを通じて外部の研究者や企業に提供しています。細胞と人工アミノ酸は自前で購入して頂いています。
- 大腸菌
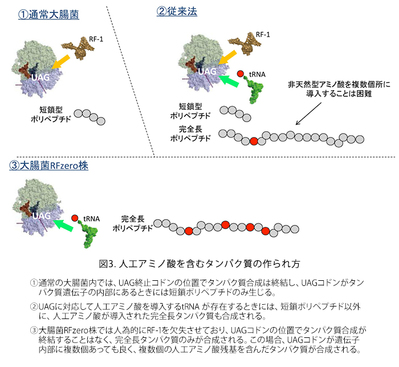
大腸菌を使って人工アミノ酸をタンパク質に導入する手法は様々なものが開発されていますが、よく利用されているのは、上記の動物細胞と基本的に同じ技術です。完全長産物の生産効率は動物細胞よりもかなり良く、20%以上になります。大腸菌では、人工アミノ酸の導入効率は「コドン・コンテクスト」の影響を強く受けます。つまり、UAGコドンの次のコドンがA,Gで始まるコドンの場合には比較的導入効率は高く、C,Uで始まるコドンでは比較して数分の1に低下することがあります。つまり、UAG-GGA(人工アミノ酸-グリシン)等の配列は望ましく、UAG-UUC(人工アミノ酸-フェニルアラニン)等の配列ではUAGが人工アミノ酸に翻訳される効率は低いと予想されます。ただし、この法則は絶対的ではないので、やはり導入部位については試行錯誤が必要になることがあります。動物細胞と同様に、(1)人工アミノ酸を培地中に添加する、(2)人工アミノ酸の導入を可能にするしくみを載せたプラスミドで細胞を形質転換する、だけで十分です。このようなプラスミドはMTAを通じて外部の研究者や企業に提供しています。細胞と人工アミノ酸は自前で購入して頂いています。 - 大腸菌RFzero株
この大腸菌株では、UAGコドンの持つ意味が人工アミノ酸に完全に再定義されています。つまり、この大腸菌の中ではUAGコドンはタンパク質合成の終止を意味せず、通常のセンス・コドンのようにアミノ酸を指定しています。この大腸菌株の開発を持って、人為的な遺伝暗号の改変が本当の意味で成功したと考えています。UAGコドンは遺伝子中で何度使用しても良く、人工アミノ酸は何か所でもタンパク質に導入できることになります。UAGコドンはもはや終止コドンとして働くことがないので、不完全長のタンパク質産物が生じることはなく、人工アミノ酸が導入された完全長タンパク質のみが合成されます。完全長産物の生産効率は、UAGコドンで中断されていない野生型産物と同じになります。人工アミノ酸を1か所だけ導入する場合には、導入位置の違いによる生産効率の変化はほとんどありませんが、人工アミノ酸を複数個所導入する場合には、合成されるタンパク質の性質によって沈殿したり、合成されなかったりすることがあります。人工アミノ酸の導入のためには、このアミノ酸を培地中に添加するだけになります。実際は、RFzeroではUAGコドンが人工アミノ酸に再定義されていますので、この人工アミノ酸は株の生育には必須になっており、培地中に常に添加している必要があります。UAGがどの人工アミノ酸に再定義されているかによって株が異なります。今のところ、3-ヨードチロシン、3-ブロモチロシン、3-クロロチロシン、4-アジドフェニルアラニンに対応したそれぞれ対応したRFzero株をMTA、及び遺伝子組み換え生物搬出の手続きを経てご提供させて頂いています。これら以外の人工アミノ酸については、RFzero株の改良株(未発表)を用いることで、タンパク質に効率良く導入することができます。
参考文献
[Photo-crosslinking]
[Probing cation-pi interactions involved in the catalytic activity of an enzyme]
[Site-selective modification of proteins]
[Incorporation of synthetic amino acids in mammalian cells]
[Incorporation of synthetic amino acids in insect cells]
[E. coli RFzero strains]]
[Experimental procedures]