チームリーダー

タンパク質の新しい原理の創出と革新的応用を目指します。
※2018年4月の組織改編により、当研究室は生命機能科学研究センターの所属になりました。最新の情報は下記よりご覧ください。
> 生命機能科学研究センター 非天然型アミノ酸技術研究チーム のページ

チームリーダー
坂本 健作
〒230-0045 神奈川県横浜市鶴見区末広町 1-7-22 西研究棟 2F W223号室
Tel: 045-503-9459
![]()
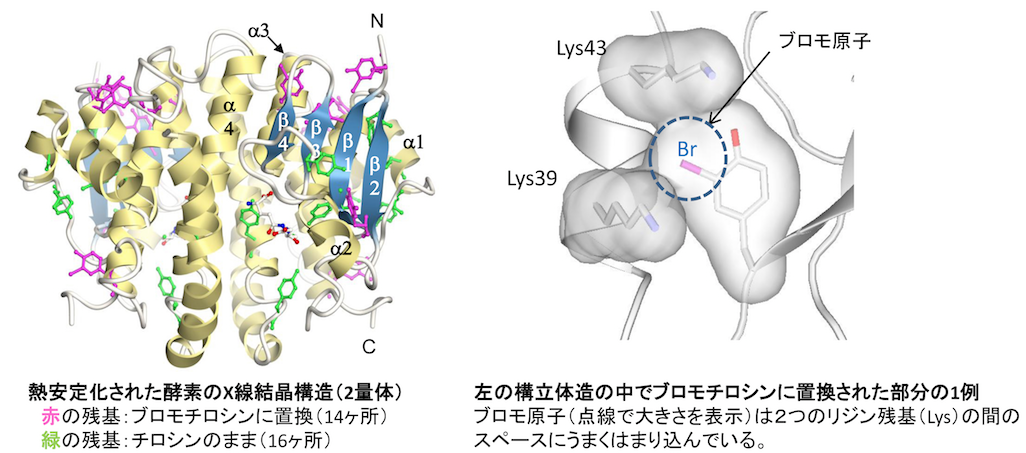
医療や生命科学研究に有用なタンパク質を合成する方法として、生きた細胞にタンパク質の設計図を読みこませて、細胞に作ってもらうことができます。本来なら生き物が使わない新規なアミノ酸をも使えるように改変した細胞を用いると、目的のタンパク質に目印をつけたり、薬剤と連結したりすることが容易になります。また、これまでにない新しいタンパク質の形や働きを実現することができるかもしれません。新規アミノ酸のような人工のコンポーネントを含んだタンパク 質の生産技術を開発し、創薬に対してもユニークで最先端の技術支援を行います。
現在流行りの「合成生物学(Synthetic Biology)」ですが、これと言って決まった定義はありません。私たちは、その有用性に着目し、従来の天然資源に依存した発見から、人為的に作成した多様性の中から新しいものを見出すことへとアプローチが変化している現状が、合成生物学の背景にあると考えています。ここでは、そのコンセプトと、生物の各階層における多様性の基盤についてまとめてみました(下図)。
新規アミノ酸をタンパク質の望みの部位に自在に導入する私たちの技術を使って、タンパク質の修飾が簡単になりました。今後、バイオ医薬品はタンパク質そのままではなく、手を加えた状態(修飾体)で効用をアップすることが望まれます。ここでは、昆虫細胞を遺伝的に改変して新規アミノ酸(AzF)の導入を可能にしています(下図)。




CLSTは、2018年4月1日からの理化学研究所第4期中期計画により、3つのセンターに改組されました。非天然型アミノ酸技術研究チームの最新の情報は、下記よりご覧いただけます。
▶ 生命機能科学研究センター 非天然型アミノ酸技術研究チーム [http://www.bdr.riken.jp/jp/research/labs/sakamoto-k/index.html]
▶ このままCLSTのウェブサイトを閲覧する [メッセージが消えます]